Tata nama senyawa kimia
Tata nama senyawa kimia adalah serangkaian aturan persenyawaan kimia yang disusun secara sistematis. Tata nama kimia disusun berdasarkan aturan IUPAC (International Union of Pure and Applied Chemistry).
Senyawa ionik
Senyawa ionik terbentuk dari kation (ion positif) dan anion (ion negatif). Kebanyakan senyawa ionik merupakan senyawa biner, yaitu senyawa yang terbentuk hanya dari dua unsur. Untuk senyawa ionik biner, penamaan dimulai dari kation logam kemudian diikuti anion nonlogam dan diberi akhiran -ida. Untuk kation yang memiliki lebih dari satu jenis muatan (bilangan oksidasi), diberikan keterangan angka romawi di tengahnya sesuai besarnya muatan.
| Golongan | Unsur | Nama Ion | Rumus Ion |
|---|---|---|---|
| IA | Litium | kation litium | Li+ |
| Natrium | kation natrium | Na+ | |
| Kalium | kation kalium | K+ | |
| IIA | Berilium | kation berilium | Be2+ |
| Magnesium | kation magnesium | Mg2+ | |
| Kalsium | kation kalsium | Ca2+ | |
| Stronsium | kation stronsium | Sr2+ | |
| Barium | kation barium | Ba2+ | |
| IB | Perak | kation perak | Ag+ |
| IIB | Seng | kation seng | Zn2+ |
| IIIA | Aluminium | kation aluminium | Al3+ |
| Golongan | Unsur | Nama Ion | Rumus Ion |
|---|---|---|---|
| VA | Nitrogen | anion nitrida | N3- |
| Fosfor | anion fosfida | P3- | |
| VIA | Oksigen | anion oksida | O2- |
| Belerang | anion sulfida | S2- | |
| VIIA | Fluorin | anion fluorida | F- |
| Klorin | anion klorida | Cl- | |
| Bromin | anion bromida | Br- | |
| Iodin | anion iodida | I- |
| Golongan | Unsur | Nama Ion | Rumus Ion |
|---|---|---|---|
| VIB | Kromium | Krom (II) atau Kromo | Cr2+ |
| Krom (III) atau Kromi | Cr3+ | ||
| VIIB | Mangan | Mangan (II) atau Mangano | Mn2+ |
| Mangan (III) atau Mangani | Mn3+ | ||
| VIIIB | Besi | Besi (II) atau Fero | Fe2+ |
| Besi (III) atau Feri | Fe3+ | ||
| Kobalt | Kobalt (II) atau Kobalto | Co2+ | |
| Kobalt (III) atau Kobaltik | Co3+ | ||
| IB | Tembaga | Tembaga (I) atau Cupro | Cu+ |
| Tembaga (II) atau Cupri | Cu2+ | ||
| IIB | Raksa | Merkuri (I) atau Merkuro | Hg22+ |
| Merkuri (II) atau Merkuri | Hg2+ | ||
| IVA | Timah | Timah (II) atau Stano | Sn2+ |
| Timah (IV) atau Stani | Sn4+ | ||
| Timbal | Timbal (II) atau Plumbum | Pb2+ | |
| Timbal (IV) atau Plumbik | Pb4+ |
Senyawa molekuler
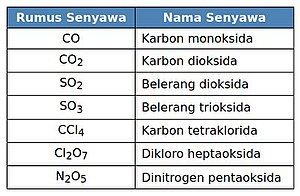
Kebanyakan senyawa molekuler termasuk senyawa biner. Senyawa molekuler tersusun dari unsur-unsur nonlogam. Penamaan dimulai dari unsur nonlogam pertama lalu diikuti nama unsur nonlogam yang diberi akhiran -ida. Jika dua unsur nonlogam dapat membentuk lebih dari dua jenis senyawa, digunakan awalan bahasa Yunani, yaitu suatu awalan yang sesuai dengan indeks dalam rumus kimianya.[1]
| Jumlah | Nama | Jumlah | Nama |
|---|---|---|---|
| 1 | mono- | 6 | heksa- |
| 2 | di- | 7 | hepta- |
| 3 | tri- | 8 | okta- |
| 4 | tetra- | 9 | nona- |
| 5 | penta- | 10 | deka- |
Namun, senyawa molekuler yang mengandung hidrogen tidak menggunakan awalan bahasa Yunani, tetapi menggunakan nama umum yang tidak sistematis.[1]
| Rumus Senyawa | Nama Senyawa |
|---|---|
| B2H6 | Diboran |
| CH4 | Metana |
| SiH4 | Silan |
| NH3 | Amonia |
| PH3 | Fosfin |
| H2O | Air |
| H2S | Hidrogen sulfida |
Senyawa ion poliatomik
Penamaan dimulai dari ion positif (kation) lalu dilanjutkan dengan ion negatif (anion).
Untuk ion logam yang memiliki lebih dari satu jenis muatan, diberikan keterangan angka romawi di tengahnya sesuai besar muatan.[2]
| Nama Ion | Rumus Ion | Nama Ion | Rumus Ion |
|---|---|---|---|
| Sulfat | SO42- | Hidrogen Fosfat | HPO42- |
| Sulfit | SO32- | Dihidrogen Fosfat | H2PO4- |
| Nitrat | NO3- | Bikarbonat | HCO3- |
| Nitrit | NO2- | Bisulfat | HSO4- |
| Hipoklorit | ClO- | Merkuri (I) | Hg22+ |
| Klorit | ClO2- | Amonia | NH4+ |
| Klorat | ClO3- | Fosfat | PO43- |
| Perklorat | ClO4- | Fosfit | PO33- |
| Asetat | CH3COO- | Permanganat | MnO4- |
| Kromat | CrO42- | Sianida | CN- |
| Dikromat | Cr2O72- | Sianat | OCN- |
| Arsenat | AsO43- | Tiosianat | SCN- |
| Oksalat | C2O42- | Arsenit | AsO33- |
| Tiosulfat | S2O32- | Peroksida | O22- |
| Hidroksida | OH- | Karbonat | CO32- |
Berikut contoh penamaan senyawa ion poliatomik:
| Rumus Senyawa | Nama Senyawa |
|---|---|
| NH4Cl | Amonium klorida |
| NaNO3 | Natrium nitrat |
| MgSO4 | Magnesium sulfat |
| KCN | Kalium sianida |
| Zn(OH)2 | Seng(II) hidroksida (bilangan oksidasi seng = 2) |
| FeC2O4 | Besi(II) oksalat (bilangan oksidasi besi = 2) |
| Fe2(SO4)3 | Besi(III) sulfat (bilangan oksidasi besi = 3) |


